Una ecuación química es una expresión de un proceso químico. Por ejemplo:
Coeficientes son usados en todas las ecuaciones químicas para mostrar la cantidad relativa de cada sustancia presente. Esta cantidad puede representar además el número relativo de moléculas,
o de moles (descrito abajo). Si no hay coeficiente se asume que el valor es uno.
En algunas ocasiones, una variedad de información será escrita sobre o debajo de la flecha de la reacción. Información, tal como la temperatura necesaria o más propicia para que la reacción tenga lugar. Por ejemplo,
en el gráfico de abajo, las notaciones superiores e inferiores de la flecha indican que necesitamos Fe2O3, a 1000 grados C, y a una presión de 500 atmósferas para que esta reacción ocurra.
El gráfico inferior representa la absorción de humedad inferior del concepto descrito arriba:
La conversión entre moles y gramos en una sustancia es a menudo frecuente.
Esta conversión puede ser hecha fácilmente si se conoce el peso atómico del elemento o la masa molecular de la/s sustancia/s. Dado el peso atómico/masa molecular, determinaremos cuantos gramos son los moles conocidos o al revés.
Por ejemplo, el calcio tiene un peso atómico de 40 uma (unidades de masa atómica). Por tanto, 40 gramos de calcio hacen un mol, 80 gramos hacen dos moles, etc.
elementos para representar el número relativo de moléculas de cada compuesto. Este es el caso cuando las ecuaciones no están ajustadas. Consideremos las siguientes ecuaciones:
Al + Fe3O4 ---> Al2O3
Puesto que no hay coeficientes delante de cualesquiera de los elementos, es fácil asumir que un mol de Al y un mol de Fe304 reaccionan para formar un mol de Al203. Si éste fuera el caso, la reacción sería absolutamente espectacular: un átomo de aluminio aparecería de la nada, y dos átomos de Hierro y un átomo de oxígeno podrían desaparecer mágicamente.
Sabemos por la Ley de la Conservación de la Materia (que la materia ni se crea, ni se destruye, sólo se
transforma) y por tanto no es posible lo apuntado. Hemos de comprobar que coincide el número de átomos de cada elemento en los reactivos y en los productos obtenidos. Para hacer esto, tendremos en cuenta los productos de los moles del compuesto por el coeficiente de cada elemento.
El ajuste de una ecuación química es esencial verificarlo a base de prueba y error.
Hay diferentes formas y sistemas para hacerlo, pero lo importante es conocer el número de átomos de cada elemento en la ecuación. Por ejemplo buscaremos los siguientes elementos.
2Fe3O4
éste elemento expresa dos moléculas de Fe3O4.
En cada molécula de esta sustancia hay tres átomos de Fe. Por lo tanto en dos moléculas de la sustancia debe de haber seis átomos de Fe. Similarmente hay cuatro átomos de oxígeno en una molécula de la sustancia por lo que que deberíamos tener ocho átomos de oxígeno en dos moléculas.
Ahora probamos ajustar la ecuación mencionada antes:
Al + Fe3O4 --->
Al2O3+ Fe
Desarrollar una estrategia puede ser difícil, pero hay una forma de aproximarse a resolver un problema como este.
1) Cuenta los átomos a cada lado de la reacción entre los reactivos y obtenidos
2) Elige un elemento para ajustar primero. El oxígeno suele ser más el más difícil de ajustar, por lo que empezaremos por él. La forma más sencilla para ajustar el oxígeno es:
Al +3 Fe3O4 --->
4Al2O3+Fe
Comprobemos que coinciden los átomos totales de cada elemento. En el lado de los reactivos, tenemos un coeficiente de tres que multiplicamos por el subíndice cuatro, lo que nos da doce átomos de oxígeno. En el lado de los productos obtenidos, tenemos un coeficiente de cuatro que multiplicaremos por tres, dando
también doce átomos de oxígeno. Ahora, los oxígenos están ajustados a ambos lados.
3) Elige otro elemento para ajustar. Lo hacemos con el hierro, Fe. Teníamos nueve átomos de Fe en el elemento en el cual el oxígeno está ajustado y aÑadimos un coeficiente de nueve frente al Fe. Tenemos ahora:
Al +3 Fe3O4 --->
4Al2O3+9Fe
4) Ajuste del último elemento. En este caso, teníamos ocho átomos de Al en el lado derecho por lo tanto necesitamos tener ocho en el lado izquierdo, para lo que habrá que aÑadir ocho ante el Al en el lado izquierdo de reactivos.
Ahora, ya tenemos la ecuación ajustada correctamente:
8Al + 3Fe3O4 --->
4Al2O3 + 9 Fe
A veces al reaccionar dos o más sustancias, entre sí, una lo hace más rápida que la otra. A este se le denomina reactivo limitador. A menudo, es necesario identificar dicho reactivo en un problema.
Ejemplo: Un químico sólo tiene 6.0 gramos de C2H2 y un suministro abundante de oxígeno, deseando producir tanto CO2 como sea posible. Usando la ecuación siguiente, ¿Cuanto oxígeno deberemos aÑadir a la reacción?
2C2H2(g) + 5O2(g) --->
4CO2(g) + 2 H2O(l)
Para resolver este problema, es necesario determinar cuanto oxígeno debemos aÑadir si todos los reactivos intervienen (este es el camino para producir la máxima cantidad posible de CO2).
Primero, calcularemos el número de moles de C2H2 en 6.0 gramos de C2H2. Para llegar a calcular los moles necesitamos buscar en la tabla periódica y veremos que un mol de C pesa 12.0 gramos y un mol de H 1.0 gramos. Además sabemos que un mol de C2H2 pesa 26 gramos (2*12 gramos + 2*1 gramos).
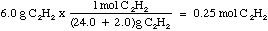
Entonces, como tenemos cinco moléculas de oxígeno para cada dos moléculas de C2H2, necesitamos multiplicar el resultado por 5/2 para obtener el total de moléculas de oxígeno. Luego convertimos a gramos para hallar la cantidad de oxígeno que necesitan ser aÑadidos:
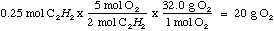
Es posible calcular la
relación molar o fracción molar entre elementos y el total en una ecuación química cuando se conoce el porcentaje en peso de los productos o de los reactivos.
masa = masa de uno de los elementos/ suma de masas de todo los elementos
Hay dos tipos de problemas de Composición en porcentaje -- problemas en los que se da la fórmula (o el peso de cada elemento) y se pide calcular el porcentaje de cada elemento y problemas en los que se dan los porcentajes y se pide calcular la fórmula.
En los problemas de concentración en porcentaje, hay varias posibles soluciones. Se puede duplicar la respuesta. Por ejemplo, CH y C2H2 tiene las mismas proporciones, pero tenemos diferentes compuestos. Generalmente daremos la fórmula más sencilla denominada --
fórmula empírica. Cuando calculamos la fórmula empírica a partir del porcentaje, se pueden convertir los porcentajes a gramos. Por ejemplo, asumiendo que se tienen 100 gramos totales, y el porcentaje de uno de los elementos es 54.3% le corresponden 54.3 gramos de los 100 gramos totales. Convirtamos ahora las masas a moles si nos dan la relación molar. Es necesario reducirlos a
números enteros. Una buena técnica es dividir cada porcentaje molar o en gramos del elemento por el elemento menor. Entonces la relación molar puede ser transformada para escribir la fórmula empírica.
Ejemplo: Si un compuesto tiene 47.3% C (carbono), 10.6% H (hidrógeno) y
42.0% S (azufre), determinar su fórmula empírica?
Convirtiendo porcentajes a masas y asumiendo que tenemos 100
g de compuesto. Entonces pasamos a moles:
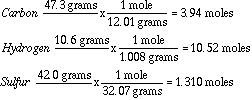
Probemos ahora a dividir cada valor en moles por el más pequeÑo, que en este caso es el de azufre:
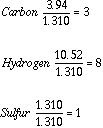
Tendremos: C3H8 S
Ejemplo: Hallemos el porcentaje en peso del ácido sulfúrico,
H2SO4.
En este problema necesitamos primero calcular el peso total del compuesto buscándolo, elemento a elemento, en la tabla periódica.
Esto nos da: 2(1.008) + 32.07 + 4(16.00) gramos/mol = 98.09 g/mol
Ahora, tenemos que tomar la fracción en peso de cada elemento sobre el peso total que acabamos de calcular y multiplicamos por 100 para obtener el porcentaje.
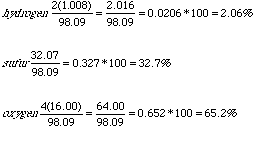
A continuación, comprobaremos que suman 100% o cantidades muy
próximas
65.2 + 2.06 + 32.7 = 99.96
Esto es aproximadamente 100 y es un error despreciable que depende de los decimales que hayamos considerado.
Por eso, la respuesta para el H2SO4 es
que está compuesto por 2.06% H, 32.7% S, y 65.2% O en peso.
Cuando la fórmula empírica es la más simple posible para un compuesto, la fórmula molecular es la forma que puede aparecer en una ecuación química.
La fórmula empírica y la molecular pueden ser coincidentes, o ser esta un múltiplo positivo de la empírica. Ejemplos de fórmulas empíricas: AgBr, Na2S,
C6H10O5. Ejemplos de fórmulas moleculares:
P2, C2O4,
C6H14S2, H2,
C3H9.
Podemos calcular la fórmula empírica a partir de las masas o de la composición centesimal de un compuesto. Ya se ha tratado de la composición centesimal arriba. Si sólo nos dan las masas, nos evitamos la conversión de de porcentajes a masas.
Ejemplo: Calcular la fórmula empírica para un compuesto con 43.7 g
P (fósforo) y 56.3 g de oxígeno. Primero convirtamos a moles:
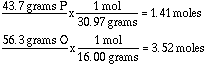
Luego dividamos los moles de cada elemento por los moles totales.
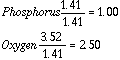
Cuando dividimos, no obtenemos números enteros, por lo que debemos dividir por el menor para encontrar la relación más sencilla entre los elementos y si es preciso multiplicar por dos o por otro número sencillo hasta que den números enteros o aproximados en una décima por encima o debajo.
(2). Respuesta=P2O5
Calcular la fórmula molecular es fácil si ya disponemos de la fórmula empírica. Si conocemos la fórmula empírica de un compuesto, todo lo que necesitamos hacer es dividir el peso molecular del compuesto por el peso dado en la fórmula empírica del compuesto.
También es posible hacerlo con uno de los elementos de la fórmula; dividiendo simplemente el peso de cada elemento en la fórmula empírica. El resultado debe ser siempre un número entero y natural.
Ejemplo: Si la fórmula empírica de un compuesto es HCN y sabemos que 2.016 gramos de hidrógeno se necesitan para formar el compuesto. Calcular la fórmula molecular. En la fórmula empírica el hidrógeno pesa
1.008 gramos. Dividiendo 2.016 entre 1.008 vemos que la cantidad de hidrógeno necesario es el doble como mucho. Además, la fórmula empírica necesita incrementarse por un factor de 2. La respuesta es pues:
H2C2N2.
Densidad
relaciona la masa por unidad de volumen de una sustancia. Es un término muy usado en química.
La concentración
de una solución es la "fuerza" de una solución. Una solución típicamente relaciona disolver algo de una sustancia sólida o líquida en un líquido, tal como un disolvente, sal o agua. A menudo se nombra el agua como disolvente a aÑadir a una solución para disminuir la concentración específica.La concentración de una solución es habitualmente dada como molaridad.
La Molaridad es definida como el número de moles de soluto (disuelto en la solución) dividido por los litros de solución
(el volúmen total, suma de soluto y disolvente).
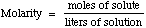 La Molaridad es probablemente el término más usado para expresar la concentración a partir de un
volumen dado de líquido.
La Molaridad es probablemente el término más usado para expresar la concentración a partir de un
volumen dado de líquido.
Ejemplo: Si 5.00 gramos de NaOH son disueltos hasta 5000 mL de agua, calcular la molaridad de la solución
El primer paso será convertir el peso de sosa dado en gramos a moles:
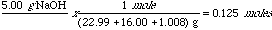 Simplemente apliquemos la definición de molaridad: moles/litros para resolver el problema
Simplemente apliquemos la definición de molaridad: moles/litros para resolver el problema
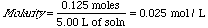
Por tanto la molaridad (M) de la solución es 0.025 mol/L.
Molalidad es otra medida común de concentración. Molalidad es definida como moles de soluto dividido entre los
kilogramos de disolvente (la
sustancia en la cual es disuelto el soluto, tal como agua).
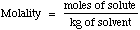 Molalidad esa veces usada en lugar de la molaridad para temperaturas extremas porque el volúmen puede sufrir contración o expansión.
Molalidad esa veces usada en lugar de la molaridad para temperaturas extremas porque el volúmen puede sufrir contración o expansión.
Ejemplo: Si la molalidad de una solución de C2H5OH
disuelta en agua es 1.5 y el peso del agua es 11.7 kg, calcular cuanto C2H5OH tendremos que aÑadir expresado en gramos a la solución
Primero
sustituimos los valores conocidos en la ecuación. Luego calcularemos los moles de soluto y consultaremos la tabla periódica para convertir de moles a gramos.

Es posible relacionar molaridad y molalidad. Sólo se necesita conocer la densidad del compuesto.
Ejemplo: Si la molaridad de una solución es 0.30 M, calcular la molalidad de la solución si se conoce que la densidad es 3.25 g/mL.
Asumimos que disponemos de un litro de solución para facilitar los calculos. Partimos de molaridad en moles/Litro y molalidad en moles/kg. Recordando que hay 1000 mL en un Litro y 1000 gramos en un kg, nos sirve para convertir molaridades y molalidades, con buena precisión, siempre que sean pequeÑos los valores.
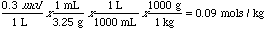 También es posible calcular las propiedades coligativas, tales como disminución del punto de ebullición a menor presión usando la molalidad. La ecuación para la disminución de la temperatura con depresión o expansión es
También es posible calcular las propiedades coligativas, tales como disminución del punto de ebullición a menor presión usando la molalidad. La ecuación para la disminución de la temperatura con depresión o expansión es
Cambiar en T= K * m
Donde: T es temperatura a depresión (por punto de congelación) o
temperatura de expansión (por punto de ebullición) (°C)
K es la constante de punto de congelación mínima absoluta (kg °C/moles)
m es molalidad en moles/kg
Ejemplo: Si el punto de congelación de la sal para carreteras es de -5.2ºC, calcular la molalidad de la salmuera (El f para el agua es 1.86 C/m.)
Un sencillo problema en el que sólo tenemos que sustituir los valores conocidos en la ecuación. Recordemos que el agua usualmente congela a 0ºC.
T=K * m
T/K= m
m = 5.2/1.86
m = 2.8 moles/kg
01. Problemas resueltos de Estequiometría




 The Shodor
Education Foundation, Inc.
The Shodor
Education Foundation, Inc. bobquim.
bobquim.